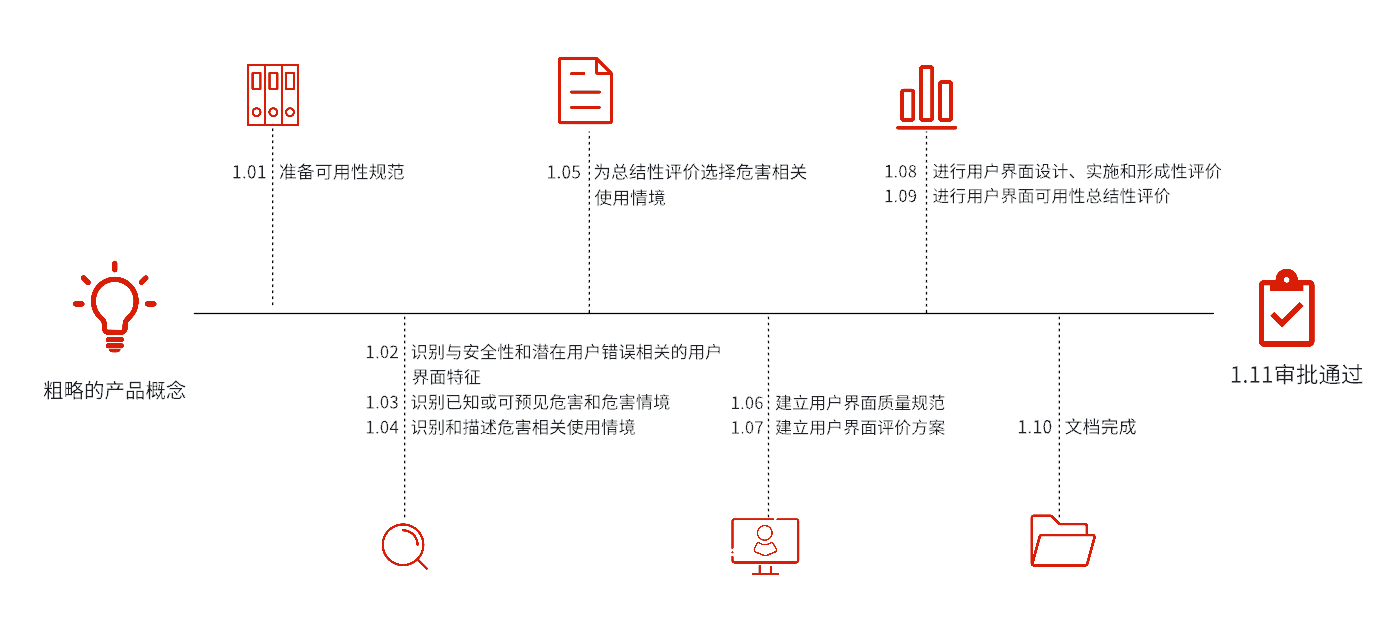
可用性工程是在产品开发中必须考虑的部分,执行标准为IEC 62366-1:2015和IEC 62366-2:2016,最终确保医疗器械可以消除可用性缺陷、控制产品风险。ISO 13485和MDR法规附录 I 明确提及可用性要求,根据不通国家法规的要求,可用性资料会被作为医疗器械注册资料的一部分。
● 专业可用性咨询服务:优化产品可用性与有效性,提升医疗器械安全性
● 遵循国际标准与法规:建立完善的可用性验证流程,如IEC62366系列标准、FDA指南等
● 用户中心设计:关注用户需求,提高产品可用性与满意度
● 多学科合作团队:全面考虑医疗器械可用性问题,优化设计与效果
壹领医疗科技拥有丰富的经验和专业知识,从制定可用性规范、制定验证方案,到招募合适的用户群参与可用性测试,我们将为您量身打造解决方案。